近日,我院罗继景教授团队在水稻护颖发育特化的调控分子机制上取得新进展,相关成果以“Dual Transcriptional Circuits: G1-OsMADS34 and G1-TGW2 Cooperatively Regulate Sterile Lemma Identity and Grain Size in Rice”为题在国际知名植物科学期刊 《Plant, Cell & Environment》 上发表。生命科学与技术学院2025届博士毕业生覃雪梅为第一作者,罗继景教授为该成果通讯作者。该研究得到了国家自然科学基金和广西科技计划项目等经费的支持。

期刊介绍
《Plant, Cell & Environment》 是国际著名出版商 Wiley 旗下的一本权威学术期刊,专注于发表植物学及其交叉学科的前沿研究。该期刊致力于整合从分子、细胞到整个植株乃至生态系统等多尺度的研究,旨在发表关于植物如何感知、响应及适应其生物与非生物环境的高质量原创成果。其研究范围广泛覆盖植物生理学、生物化学、分子生物学、环境科学、生态生理学、作物科学以及气候变化生物学等多个领域,是理解植物与环境互作机制的核心国际平台。根据最新数据显示,该期刊长期位于JCR植物科学一区(Q1),其2025年影响因子6.3,中科院分区为生物学一区Top,这充分彰显了其在植物科学领域的顶尖学术地位和全球影响力。
研究背景
水稻是全球最重要的口粮作物,其产量直接受小穗的影响(Sreenivasulu et al., 2021)。典型水稻小穗包含一朵可育小花和两对特化苞片(护颖与副护颖),这一结构对籽粒发育与形态建成至关重要(Kyoko et al., 2004; Itoh et al., 2005)。水稻穗发育始于茎顶端分生组织向花序分生组织的转化,随后逐步形成各级枝梗分生组织、小穗分生组织,最终分化为花器官(Itoh et al., 2005)。该过程受经典“ABCDE”花器官特性基因模型调控,共同决定花器官属性。护颖作为小穗关键组成部分,其发育依赖一个复杂的多基因调控网络,涉及转录因子、表观遗传调控及激素信号等多个模块(Zhuang et al., 2020; 罗曦 等, 2021; Li et al., 2025)。然而,该网络中基因的层级关系与互作机制尚不明确,是当前研究的核心难点。尽管已克隆多个护颖相关基因,护颖发育的分子路径仍有待进一步研究。解析护颖调控网络,不仅有助于阐明水稻花器官特有性状的形成机制,也可深化对单子叶植物花器官发育规律的认识。
研究内容
1、护颖发育控制基因 G1的克隆
科研团队以长护颖籼稻LG7和短护颖的粳稻日本晴(Nipponbare)为亲本杂交构建定位群体,克隆了调控水稻护颖的关键基因G1。该基因编码区存在一个 SNP(+323G/A),导致其蛋白第108位氨基酸由丝氨酸变为天冬酰胺(S108N)。与以往报道(Yoshida et al., 2009; Hong et al., 2010; Liu et al., 2016; Fang et al., 2024)位点不同,这是一个新的影响护颖发育的变异位点。研究进一步证实G1具有转录因子功能,敲除该基因会导致籽粒增大,表明它作为负调控因子参与籽粒大小的调控。
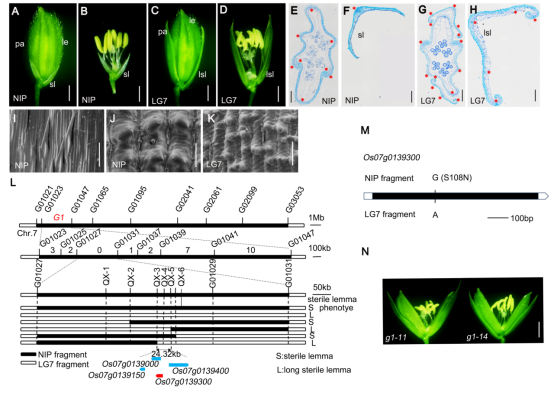
图1 G1基因的图位克隆。
2、G1与OsMADS1形成负反馈回路抑制OsMADS1表达调控护颖的发育
为了阐明G1参与调控水稻护颖发育的分子机制,研究团队以G1的过表达植株的幼穗为材料,进行ChIP-seq实验,结果显示,G1能够结合到CArG-box和YACTGTW(Rieu et al., 2024)基序上;此外,我们发现OsMADS1(叶状颖壳不育基因)(Qin et al., 2025)、OsMADS34(MADS-box转录因子)和TGW2(粒宽和粒重)作为其下游的候选靶基因。进一步的研究发现G1可结合 OsMADS1启动子的CArG-box和YACTGTW基序并抑制其转录,且二者蛋白存在物理互作,形成负反馈调控通路。
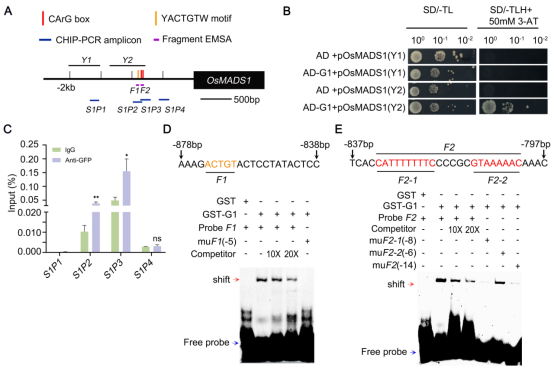
图2 G1蛋白与OsMADS1启动子区域结合
3、G1与OsMADS34形成正反馈回路激活OsMADS34表达控制护颖的发育过程
基于ChIP-seq实验的结果,研究团队进行进一步验证,发现G1能够结合OsMADS34启动子的CArG-box和YACTGTW基序并激活其转录,且二者蛋白存在物理互作,形成正反馈调控通路。
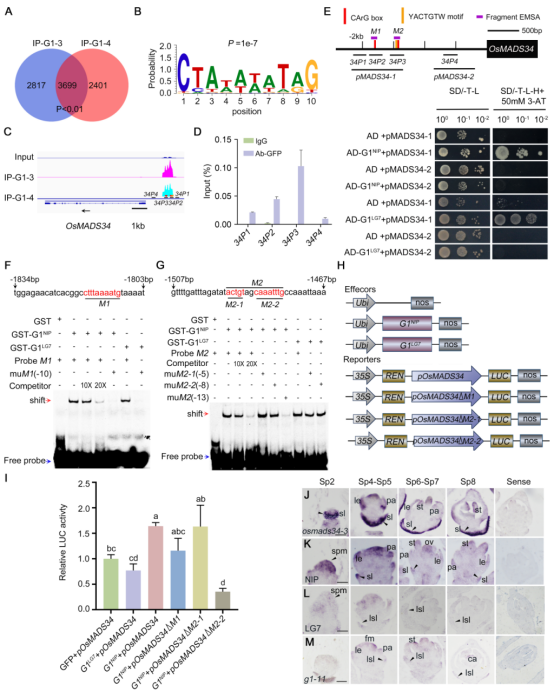
图3 G1蛋白结合OsMADS34启动子并激活其转录
4、G1与OsMADS34协同调控护颖的发育
为阐明G1与OsMADS34之间的遗传调控关系,研究团队构建了二者的双突变体。遗传分析显示,G1位于OsMADS34上游,过表达OsMADS34基因可部分回补g1突变体的护颖长度表型。
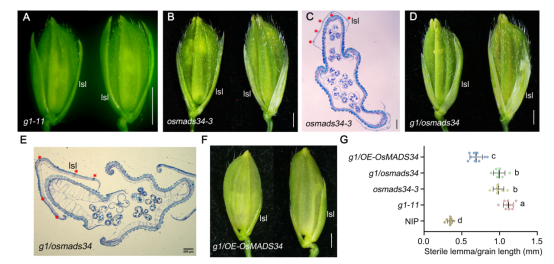
图4 g1-11、osmads34-3及g1/osmads34双突变体在开花期的小穗表型分析
5、G1与TGW2形成正反馈回路激活TGW2表达影响籽粒的发育过程。
此外,研究中我们发现与OsMADS34的反馈调控模式类似,G1与TGW2之间同样存在一个正反馈调控回路。一方面,G1结合到TGW2启动子CArG-box和YACTGTW基序并激活其转录;另一方面,G1与TGW2蛋白间的相互作用进一步增强了TGW2的表达,从而进一步巩固并增强其转录激活效应。
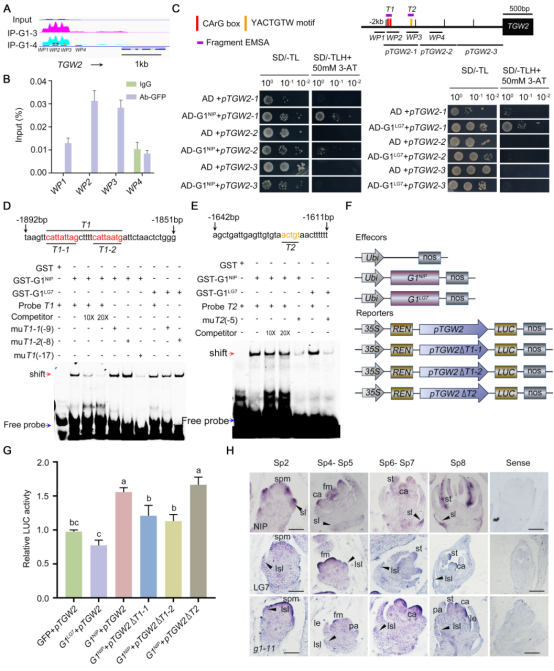
图5 G1蛋白与TGW2启动子结合并激活其表达来控制籽粒大小
6、G1是一个具有育种潜力的基因
研究团队通过进一步的遗传学分析,结果显示,在g1/OE-TGW2双突变体中,籽粒大小更接近野生型(NIP),与g1突变体相比,OE-G1-1和g1/OE-TGW2水稻植株的粒宽、糙米粒长及糙米粒宽均显著减小,其籽粒大小恢复至与NIP相当的水平。此外,与野生型相比,G1基因敲除突变体籽粒显著增大,其穗型、千粒重及单位面积产量均显著提升,而穗粒数、结实率等性状无显著变化,表明G1通过负调控籽粒大小影响产量,是水稻增产育种的重要靶点。
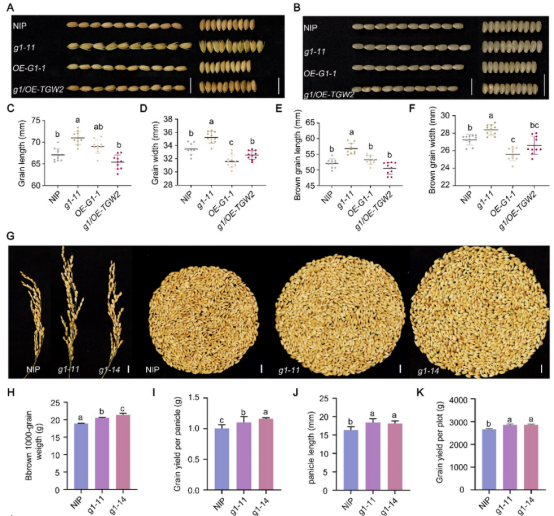
图6 籽粒大小的遗传学分析及敲除G1基因可提高产量
综上所述,本研究首次阐明了水稻G1通过靶向调控OsMADS1 (Qin et al., 2025)、OsMADS34和TGW2等多个关键基因,协同调控水稻护颖发育和籽粒大小(图 )。该成果揭示了G1基因在水稻籽粒大小调控中的新功能,为高产育种提供了新的靶点与策略。
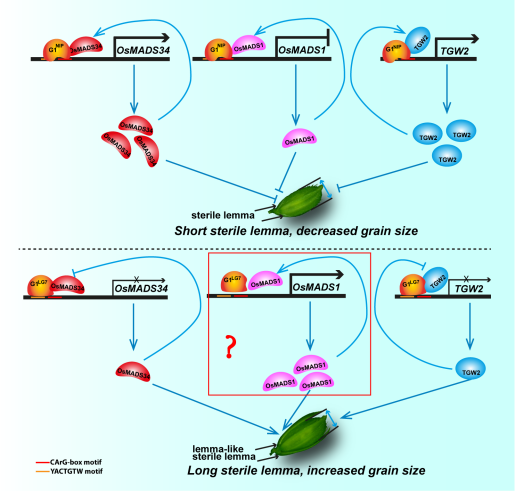
图7护颖发育基因G1的调控分子机制调控模式图
研究结论
本研究以水稻日本晴与具“类外稃退化稃片”(lsl)表型的LG7为亲本构建杂交群体,定位并克隆了控制该表型的关键基因G1。 G1等位基因存在+323G/A SNP变异,导致其编码蛋白DUF640结构域第108位丝氨酸替换为天冬酰胺(S108N)。G1基因编码一个转录因子,转基因敲除结果发现G1是调控水稻护颖发育特化的关键基因。对于G1控制护颖发育的调控网络研究发现,G1通过分别与OsMADS1(Qin et al, 2025, Plant Cell Reports)和OsMADS34启动子上的基序 YACTGTW和CArG-box结合调控这些下游基因的表达;同时,这两个基因所编码的蛋白又与G1互作形成负/正反馈调控回路,调控护颖发育。另外,我们还发现,G1通过分别与TGW2基因的启动子上的基序 YACTGTW和CArG-box 结合调控该基因的表达,而且TGW2基因所编码的蛋白也与G1互作形成正反馈调控回路,调控水稻籽粒的大小。该基因功能缺失可在不影响主要农艺性状的前提下显著提高产量,为高产育种提供了重要靶点。
作者简
罗继景教授,2009年1月博士毕业于中国科学院上海生命科学研究院植物生理生态研究所,师从林鸿宣院士,从事水稻分子遗传学方向的研究,2009年1月~2012年5月先后在美国得州农工大学和普度大学从事博士后研究工作。罗继景教授课题组长期围绕区域特色的广西普通野生稻资源的搜集、保护与利用方面开展研究。目前研究方向主要集中在耐冷、耐旱以及细菌性条斑病抗性基因分子遗传的研究。近年来在Nature Genetics, The Plant Cell, Nature Communications和 Plant Biotechnology Journal等国际知名期刊发表SCI论文30余篇。

广西大学罗继景教授课题组全体成员合影
一审一校:罗继景
二审二校:覃文月
三审三校:李伟辉